关于CHO细胞代谢和蛋白质糖基化的数学模型能说明什么
本研究为Sarah Galleguillosa, David Ruckerbauer
等发表的 “What can
mathematical modelling say about CHO metabolism and protein glycosylation?”,全文可通过搜索DOI:10.1016/j.csbj.2017.01.005获得。
近年来,中国仓鼠卵巢细胞因其是生产重组蛋白的主要宿主细胞,其工艺优化一直备受关注。通过高通量技术的发展,可以深入、定量地了解CHO细胞代谢和蛋白质糖基化的机制。在这里,我们回顾了在模拟CHO代谢和蛋白质糖基化领域中最显著的成就。
文章重点分析与重组蛋白生产相关的两个主要问题:(i)影响细胞生长和蛋白质产量的代谢;(ii)了解相关蛋白质正确的糖基化过程,这是产品质量的主要标准之一。按时间顺序文章在图1中列出在CHO细胞代谢建模方面的进展,重点研究对细胞生长有害的两种主要代谢产物的积累,即乳酸和氨。
为了更好地理解建模方法,以下做了简要说明,常见的建模方法:
MFA(代谢通量分析):拟稳态假设下基于代谢反应化学计量学和质量平衡的路径分析方法。可以通过以下几种方式实施:1.FBA(通量平衡分析)基于优化特定条件下细胞功能(如细胞生长)来实现MFA。2.13C MFA:在培养基中加入同位素标记的底物,一旦达到同位素稳定状态,就可以通过核磁共振或气相色谱-质谱法测量同位素的分布。
Markov chain Monte Carlo抽样(MCMC):糖基化过程可以描述为从一种状态到另一种状态过程的转移概率。在本文提到的文献中,这一方法用来克服动力学参数的不足。
Artificial Neural Network models(神经网络模型):目的是通过检测和“学习”可以应用于输入数据的训练集内的模式和关系,来预测复杂的非线性系统的行为。
1.乳糖的代谢
Altamirano等人研究了乳酸代谢在CHO细胞核心代谢网络中的代谢路径。他认为乳酸不能用作能量来源,因为实验测得的吸氧率与乳酸通过三羧酸循环完全氧化不一致,因此提出了丙酮酸非氧化脱羧的替代途径存在于癌细胞中,也存在于CHO细胞中。然而在最近研究中Martinez等人反驳了这个假说,通过减少小鼠衍生代谢模型中的FBA分析了从乳酸生成到乳酸吸收的代谢转换,其氧吸收速率测量结果与三羧酸循环中的乳酸氧化一致。这表明Altamirano等人的代谢网络可能过于简单,无法捕捉各个阶段之间的代谢变化。Altamirano的模型缺乏脂肪酸、类固醇和糖原代谢。此外,每摩尔碳的ATP产量预测表明乳酸消耗在能量上比葡萄糖消耗更有效。
FBA可以与同位素分析相结合,提高预测通量的准确性。Sengupta等人用13C MFA研究了细胞培养稳定期的主要代谢通量。这一阶段的典型特征是乳酸产量减少,蛋白质产量增高。同样,Templeton等人通过13C MFA来了解CHO细胞系在生长期和稳定期之间的代谢变化。他们发现,在抗体产生高峰期(稳定期)通过三羧酸循环的通量是最大的,而乳酸没有产生。此外,与以高糖酵解通量为主的指数期相比,稳定期中三羧酸循环活性的增加与氧化磷酸戊糖途径(PPP)的通量增加相关。因此增加氧化三羧酸循环(CO2生成反应)和PPP通量,将获得更高的蛋白质产量。
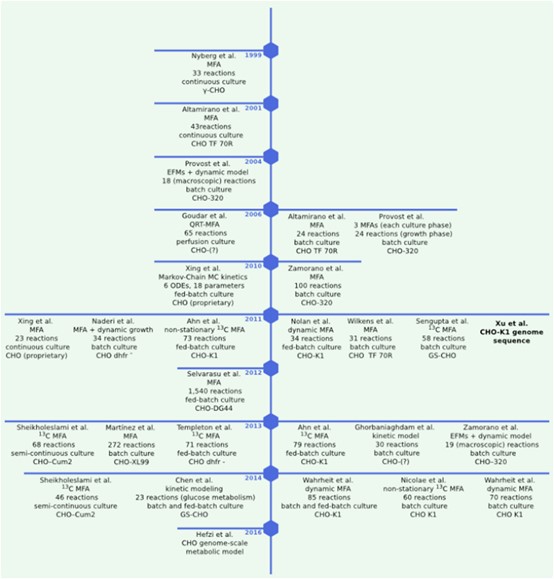
★
图1所示,按照时间顺序,列出CHO细胞的代谢建模工作
最近,Chen等人提出在培养过程开始时添加少量乳酸可以提高代谢效率。他们使用中心碳代谢动力学模型(即糖酵解、PPP和TCA循环),结合动态模型发现随着初始乳酸浓度的增加,最终乳酸的产量下降,这意味着细胞更有效地利用了葡萄糖。Li等人还发现当培养物中的葡萄糖浓度保持在较低水平时,乳酸可以作为主要的碳源。
利用非稳定的13C技术通过分析酶的局部活性,证明了在模拟代谢时考虑分隔的重要性。这些可以更准确地评估代谢通量,主要针对那些无法使用稳态方法解析的途径,像循环或平行途径(例如糖酵解和PPP)等。Nicolae等人讨论了细胞质和线粒体中乳酸产生的来源,不仅考虑到代谢物的时间演变,而且考虑到它们的空间定位,证明糖酵解和TCA循环都有额外的前体可用性这一控制因素。同样,Ahn等在包含79个反应的网络上进行了高精度的13C MFA,并准确地解析了代谢通量。在细胞生长指数阶段,主要特征是葡萄糖高通量通过糖酵解,其中70%转化为乳酸。跟之前报道一样,他们还观察到稳定期内糖酵解通量的减少和氧化PPP的增加。
Goudar等人在对CHO细胞灌注培养的代谢率估算方面取得了显著进展,从而基于代谢平衡实现最优的过程控制。他们发现降低葡萄糖和谷氨酰胺的初始浓度可使TCA循环通量增加,并减少代谢废物(主要是乳酸)的产生。Xing等人应用MCMC方法开发了分批补料培养的动力学模型,并预测了葡萄糖和谷氨酰胺的最佳初始浓度,实现氨和乳酸的产量最小化。
同样,Sheikholeslami等人使用13C MFA比较了两种半连续培养,即分别生长在含有1mM和5mM谷氨酰胺的化学限定培养基上,发现谷氨酰胺低浓度培养基中丙酮酸进入三羧酸循环的比例更高。在这种情况下,针对13C MFA的使用,是通过只分析细胞外13C标记的代谢物来进行MFA,从而预测细胞内通量的方式被简化了。
Naderi等人提出了另一种有趣的补料策略。使用MFA将代谢网络减少到一组较显著的反应,并将它们与动态细胞生长模型相结合,以评估细胞生长和凋亡之间的代谢差异。他们强调了不同细胞亚群(生长、休止和凋亡细胞)代谢率的差异,并提出了细胞培养老化的补料策略。当谷氨酰胺在非指数期过量时,会从糖酵解向谷氨酰胺脱氨转化引起氨的累积。随着培养物的老化,可以通过逐渐降低补料中的谷氨酰胺浓度来防止氨的累积。
Ghorbaniaghdam等人使用动力学模型发现,当在指数中期加入丁酸钠时,细胞的能量代谢(乳酸和葡萄糖的比例)会更高。此外,他们在描述能量代谢(以ATP表示)和氧化还原电位(以NADH、NAD+、NADPH和NADP+表示)方面也取得了显著的成就。在培养基中添加丁酸钠会增加三羧酸循环的通量,并产生较高的细胞氧化还原电位,但不会显著改变ATP的产生速率。
Selvarasu等人用MFA与统计分析方法(如主成分分析)相结合,以确定与氨和乳酸积累相关的关键代谢产物。研究中分析了细胞外和细胞内代谢物种类的分布,并将这些信息整合到小鼠来源的GSMR(基因组规模的代谢重建分析)中,目的是寻找与生长受限相关的途径。除了葡萄糖和谷氨酰胺,他们还发现天冬酰胺与培养基中氨的积累有关,最有可能是通过它转化为天冬氨酸,然后成谷氨酸,最后转化为α-酮戊二酸。
不管这些研究成果如何,模型的性能还需要进一步评估。自从第一个建模方法出现以来,实验测量值的准确性都是获得有意义结果的一个重要因素。此外,有研究表明不同细胞系的生物量组成是不同的,然而生物量组成对模型预测有很大的影响。因此,影响CHO细胞代谢模型稳定性的因素仍是一个有待解决的问题。
2.糖基化
建立代谢模型的目的是为了减少重组目的蛋白生产所引起的细胞代谢负担,提高蛋白质的产量。然而,生物制药工业不仅面临着高效生产治疗性蛋白的问题,而且还面临着高质量生产治疗性蛋白的问题。大多数治疗性蛋白的正确功能主要依赖于糖基化修饰。
已知许多因素会影响细胞培养中的糖基化:培养基中的代谢物浓度(底物和废物)、pH值、温度和细胞活力。然而,这些因素影响微观和宏观异质性的机制仍不清楚。因此,需要进行系统的分析。糖基化过程的复杂性以及许多干预因素使糖基化建模成为一项具有挑战性的任务。
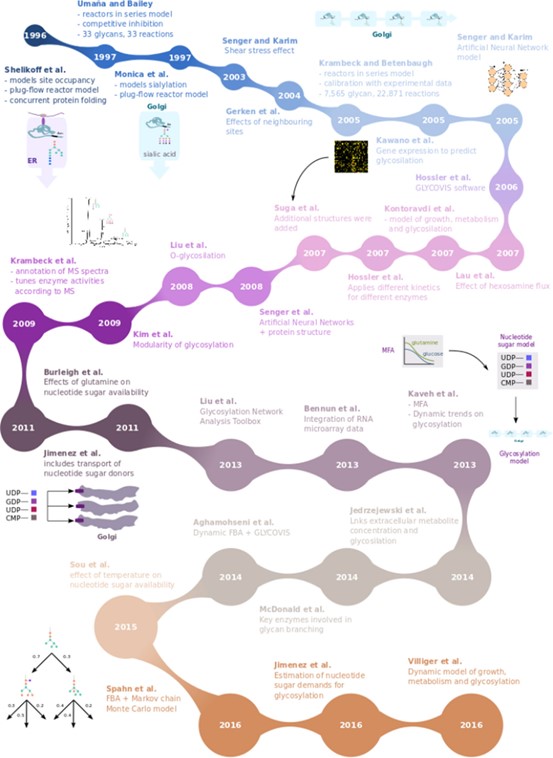
Umaña和Bailey首次尝试基于参与N-糖基化的酶的表达和空间定位来模拟糖基化异质性。高尔基体中蛋白质的半衰期、蛋白质生产力和高尔基体间室体积等参数也包括在该模型中。此外,他们修改了模型以适应内源性蛋白和重组蛋白之间糖基化机制的竞争。Kontoravdi等人使用了这种糖基化模型,并将其纳入了细胞生长、死亡和代谢的简单动态数学模型中。通过这个简化模型,他们预测了低聚糖摩尔分数随时间的演变。然而,由于缺乏实验数据,这些结果无法得到验证。几年后,Krambeck和Betenbaugh扩展了Umaña s模型(包含33个聚糖结构和33个反应),加入了大约7500个寡糖结构和超过22,000个反应。其中,岩藻糖基化和唾液酸化反应包括在模型中。与Umaña和Bailey的模型相反,该模型调整酶浓度以适应实验观察到的糖蛋白模式,从而将其校准到特定的蛋白质。他们认为,之所以有一个特殊的、调整过的模型,是因为糖基化的内在可变性:糖基结构不仅取决于特定的蛋白质,还取决于糖基化位点。通过在CHO细胞中表达的重组人血小板生成素中观察到的N-聚糖结构验证了他们的结果。这个模型后来被其他研究小组用作进一步发展的原型。
在后续研究中,Senger和Karim使用Artificial Neural Network 模型根据糖基化位点附近的一级序列信息预测糖基化。根据这个序列信息,该模型被用来将宏观异质性分为稳定的(不随培养条件变化)和可变的。他们利用关于二级结构和溶剂可及性的信息进一步改进了这种方法,从而预测了两种主要的聚糖分支:高甘露糖型和复合型。与以前的模型相比,这种方法的主要优点是它不需要大量的参数,只需要蛋白质序列(根据蛋白质序列预测二级结构)。此外,它突出了蛋白质二级和三级结构对酶的可及性的影响。
Hossler等比较了两种高尔基体中蛋白质成熟主要模型的预测性能:四个连续混合槽(4CSTR)用于膜泡运输,四个串联的活塞流反应器(4PFR)用于蛋白成熟模型。后者能更准确地描述蛋白成熟这一过程,并强调了蛋白在高尔基体停留时间和酶定位的重要性。
使用活塞流反应器模型描述单克隆抗体(mAb)糖基化。主要的改进是核苷酸糖供体的运输。这是将细胞代谢(以及葡萄糖摄取等可测量变量)与糖基化结合起来的第一步。Kaveh等人通过MFA对细胞代谢物浓度进行了动态分析,并使用之前的模型将谷氨酰胺和葡萄糖与核苷酸糖生物合成和糖酵解联系起来。该模型成功地预测了CHO细胞批次培养中产生的单抗糖谱的动态趋势。在另一项研究中,将动态MFA与Hossler等人开发的GLYCOVIS软件相结合,根据实验观察到的糖谱预测不同浓度的谷氨酰胺、葡萄糖、氨和不同pH值对糖基化过程的影响。他们使用了细胞生长和凋亡的动态模型和del Val的动态模型来预测糖基化模式。在这种情况下,使用来自生产单抗的小鼠杂交瘤细胞的实验数据进行计算。类似的研究也应用于生产单抗的CHO细胞的补料分批培养中。因此,近年来的模型成功地将细胞生长、代谢、蛋白质产率和糖基化联系起来。
糖基化模型的主要局限性是描述过程需要高级别的参数化。如前所述,在糖基化过程的不同阶段,多种因素都会对糖基化产生影响。影响因素有细胞系、糖蛋白,甚至是糖基化位点特异性,这降低了模型的普遍适用性。因此,尽管过去几年在这一领域取得了巨大的进展,其最终目标是预测不同蛋白质序列或结构对细胞系特异性行为的影响,或与过程相关的变化,糖基化仍然需要进一步的工作和优化来完全实现。
References:
1. Kyriakopoulos S,
Kontoravdi C. Analysis of the landscape of biologically-derived pharmaceuticals
in Europe: dominant production systems, molecule types on the rise and approval
trends. Eur J Pharm Sci 2013;48(3):428–41.
2. Lim Y, Wong NS, Lee
YY, Ku SC, Wong DC, Yap MG. Engineering mammalian cells in
bioprocessing–current achievements and future perspectives. Biotechnol Appl
Biochem 2010;55(4):175–89.
3.Jayapal KP, Wlaschin
KF, Hu W, Yap MG. et al. Recombinant protein therapeutics from CHO cells–20
years and counting. Chem Eng Prog 2007;103(10):40.
4.Zang M, Trautmann H,
Gandor C, Messi F, Asselbergs F, Leist C, Fiechter A, Reiser J. Production of
recombinant proteins in Chinese hamster ovary cells using a protein-free cell
culture medium. Nat Biotechnol 1995;13(4):389–92.
5.Wurm FM. 1.4 Aspects
of gene transfer and gene amplification in recombinant mamman cells. Mamm Cell
Biotechnol Protein Production 1997;
6. Walsh G.
Biopharmaceutical benchmarks 2014. Nature biotechnol 2014;32(10):992–1000.
7. Altamirano C,
Paredes C, Cairo J, Godia F. Improvement of CHO cell culture medium
formulation: simultaneous substitution of glucose and glutamine. Biotechnol
Prog 2000;16(1):69–75.
8.Rajendra Y, Kiseljak
D, Baldi L, Hacker DL, Wurm FM. Reduced glutamine concentration improves
protein production in growth-arrested CHO-DG44 and HEK-293e cells. Biotechnol
Lett 2012;34(4):619–26.
9.McDonald AG, Hayes
JM, Bezak T, Głuchowska SA, Cosgrave EF, Struwe WB, Stroop CJ, Kok H, van de
Laar T, Rudd PM. et al. Galactosyltransferase 4 is a major control point for
glycan branching in N-linked glycosylation. J Cell Sci 2014;127(23):5014–26.
10.Senger RS, Karim MN.
Effect of shear stress on intrinsic CHO culture state and glycosylation of
recombinant tissue-type plasminogen activator protein. Biotechnol Prog
2003;19(4):1199–209.
11.Kaveh O, Hengameh A,
Johannes G, Murray M-Y, Raymond LL, Jeno S, Hector BM. Novel dynamic model to
predict the glycosylation pattern of monoclonal antibodies from extracellular
cell culture conditions. IFAC Proc Vol 2013;46(31):30–5.
12. Aghamohseni H,
Ohadi K, Spearman M, Krahn N, Moo-Young M, Scharer JM, Butler M, Budman HM.
Effects of nutrient levels and average culture pH on the glycosylation pattern
of camelid-humanized monoclonal antibody. J biotechnol 2014;186:98–109.
13. Shanmuganathan S,
Samarasinghe S. Artificial neural network modelling, studies in computational
intelligence. Springer International Publishing; 2016
14.Hefzi H, Ang KS,
Hanscho M, Bordbar A, Ruckerbauer D, Lakshmanan M, Orellana CA, Baycin-Hizal D,
Huang Y, Ley D. et al. A consensus genomescale reconstruction of Chinese
hamster ovary cell metabolism. Cell Syst 2016;3(5):434–43.

 微信公众号
微信公众号