细胞周期控制策略在CHO细胞工艺的最新应用
细胞周期控制策略在CHO细胞工艺的最新应用
单克隆抗体主要采用重组CHO细胞进行分批补料培养生产,调控重组CHO细胞增殖可以增加重组蛋白的产量,但细胞过度生长也可能造成蛋白产量降低。有研究表明将细胞周期阻滞在G1(G0)或G2/M期会降低细胞比生长速率(μ),但能够增加单位细胞蛋白生成率(qP),进而增加蛋白产量。
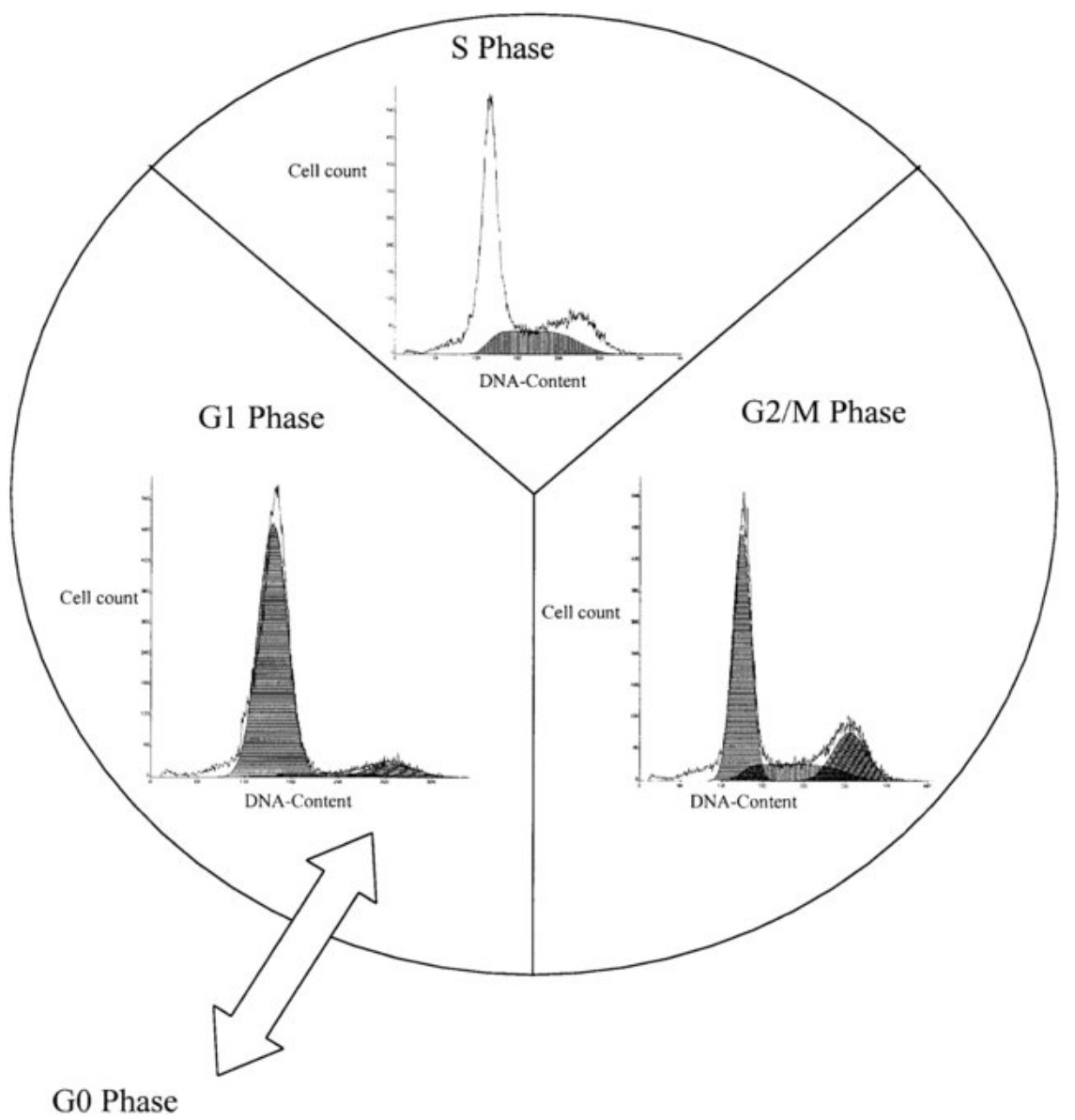
图 <!--[if supportFields]> SEQ 图 \* ARABIC 1<!--[if supportFields]>
通过流式细胞分析CHO细胞周期1
细胞周期抑制相关方法在生物工艺阶段已被广泛使用,以增加qP和产物表达。
例如:氨基酸限制,水解物的添加,培养条件(温度、Osmo)改变,或者short-chain fatty acid(丁酸、戊酸等)的使用。
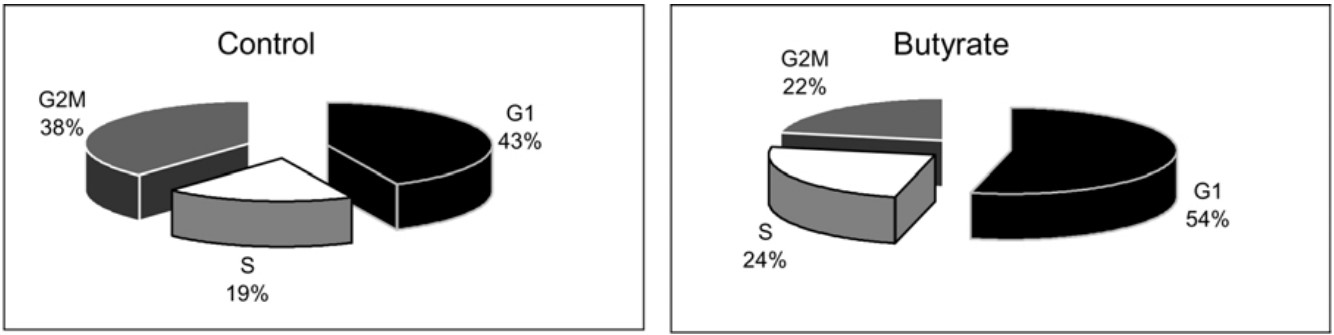
图
<!--[if supportFields]> SEQ 图
\* ARABIC 2<!--[if supportFields]> 1mM丁酸钠加入72小时后流式检测细胞周期分布情况2
但是上述方法在控制细胞周期以外,还靶向其他多个细胞内靶点,因此它们在不同条件如不同的宿主细胞、单克隆、表达产物、培养基和工艺条件下,结果往往不是一成不变的。
近年来,随着技术设备和工艺理解的不断加深,生物制药行业对细胞周期的调控方法不断优化,通过基因改造、工艺方法优化以及在线监控(PAT)等方法,以求更有针对性的调控细胞周期。
GSK公司2022年发表的文章,阐述了在CHO细胞培养(Fed-batch和Perfusion)使用在线流式细胞术分析不同CHO细胞系的细胞周期和凋亡的进展。将流式细胞术作为一种工艺过程分析技术工具集成到生物工艺中,有助于建立最佳工艺条件和工艺控制3。
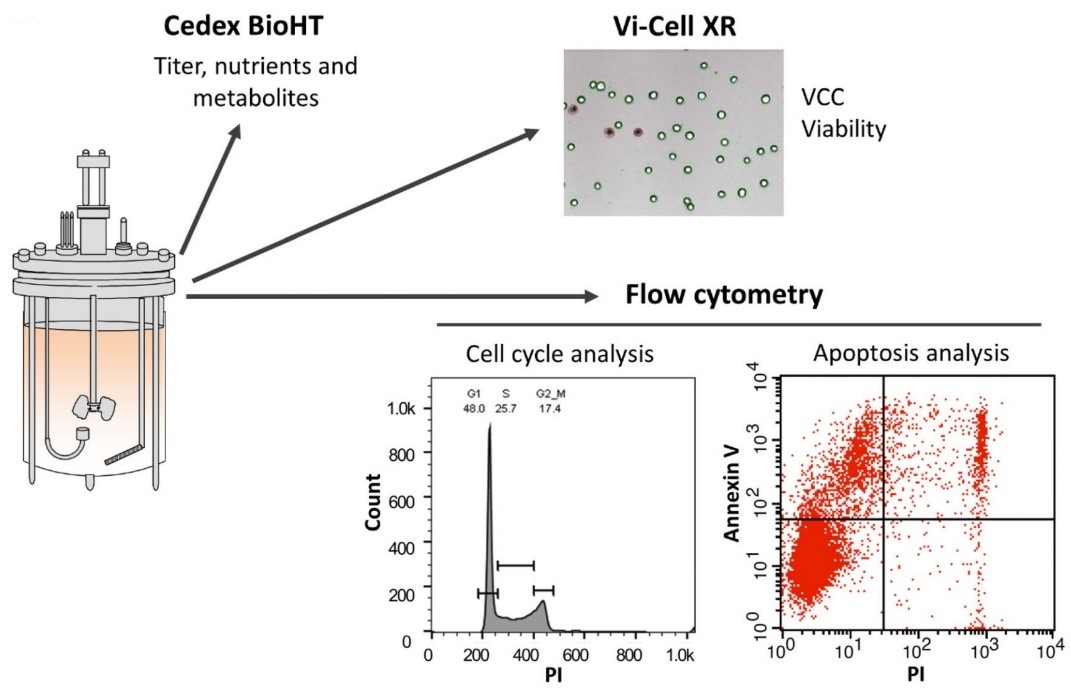
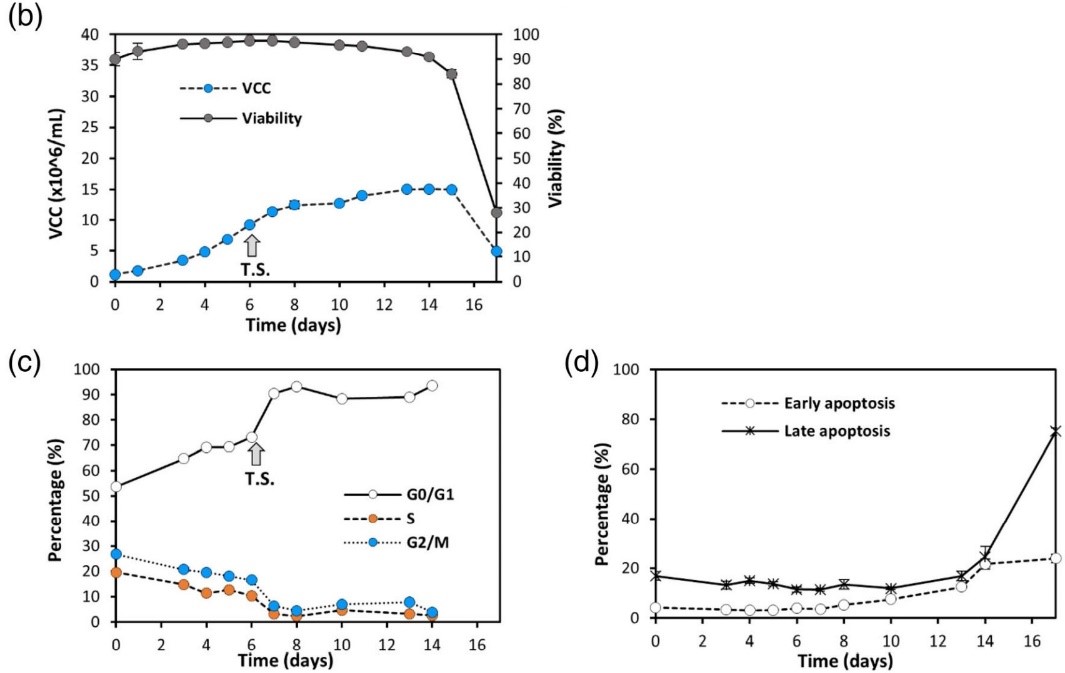
图
<!--[if supportFields]> SEQ 图
\* ARABIC 3<!--[if supportFields]> 在线流式检测细胞周期和细胞凋亡3
近年来,随着如双抗,scFv,融合蛋白等特殊结构蛋白产品规模不断扩大,将细胞生长阶段(Expansion)和蛋白生产阶段(Production)进行脱钩,可以减轻细胞毒性负产物对产品质量和稳定性的不良影响。
在不产生重组蛋白(生长阶段),将细胞生长推至高细胞密度,通过诱导基因表达系统或者定向合成小分子化合物,定向性的阻断增殖途径来阻止细胞生长,诱导重组蛋白的表达并停止细胞增殖(生产阶段)4。
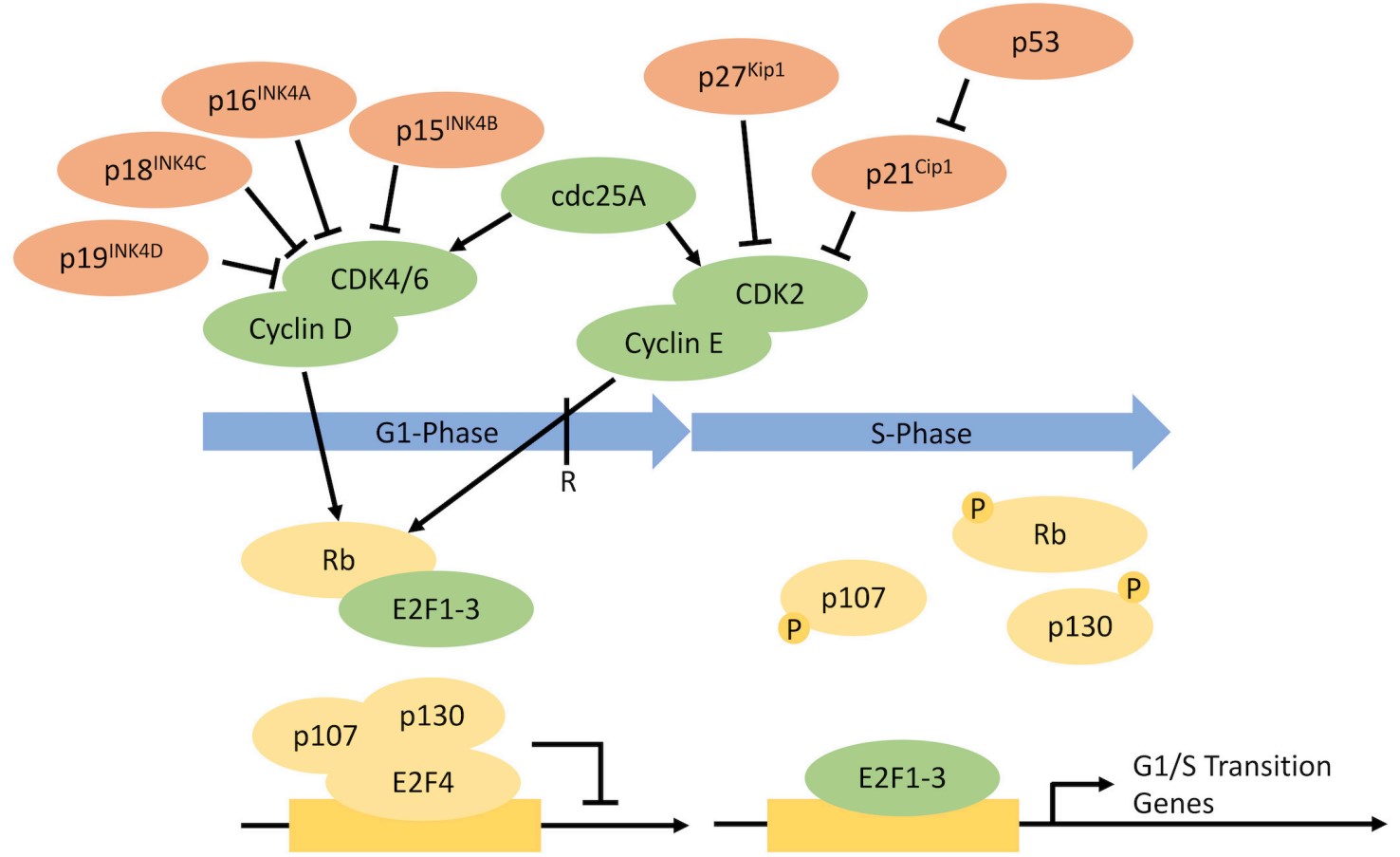
图 <!--[if supportFields]> SEQ 图
\* ARABIC 4<!--[if supportFields]>
G1到S期的进展由一系列细胞周期调节剂控制,红色靶点表示潜在过表达基因,绿色靶点为基因敲除/蛋白质降解的潜在目标4
在此背景下,Amgen公司通过合成小分子化合物CCI,靶向性抑制细胞周期蛋白依赖性激酶 CDK4/6,在多个CHO细胞系上成功的造成G0/G1期的阻滞,并且不影响 G2/M期细胞活动5。
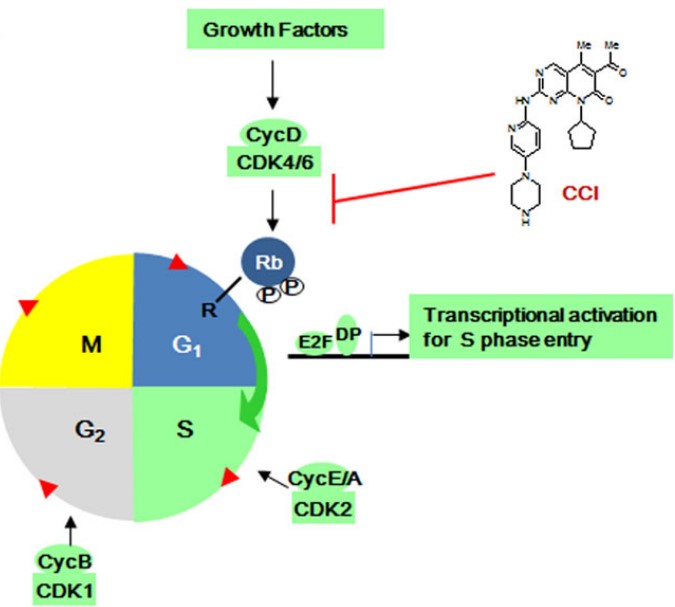
图 <!--[if supportFields]> SEQ 图 \*
ARABIC 5<!--[if supportFields]> 小分子化合物CCI靶向CDK4/6 5
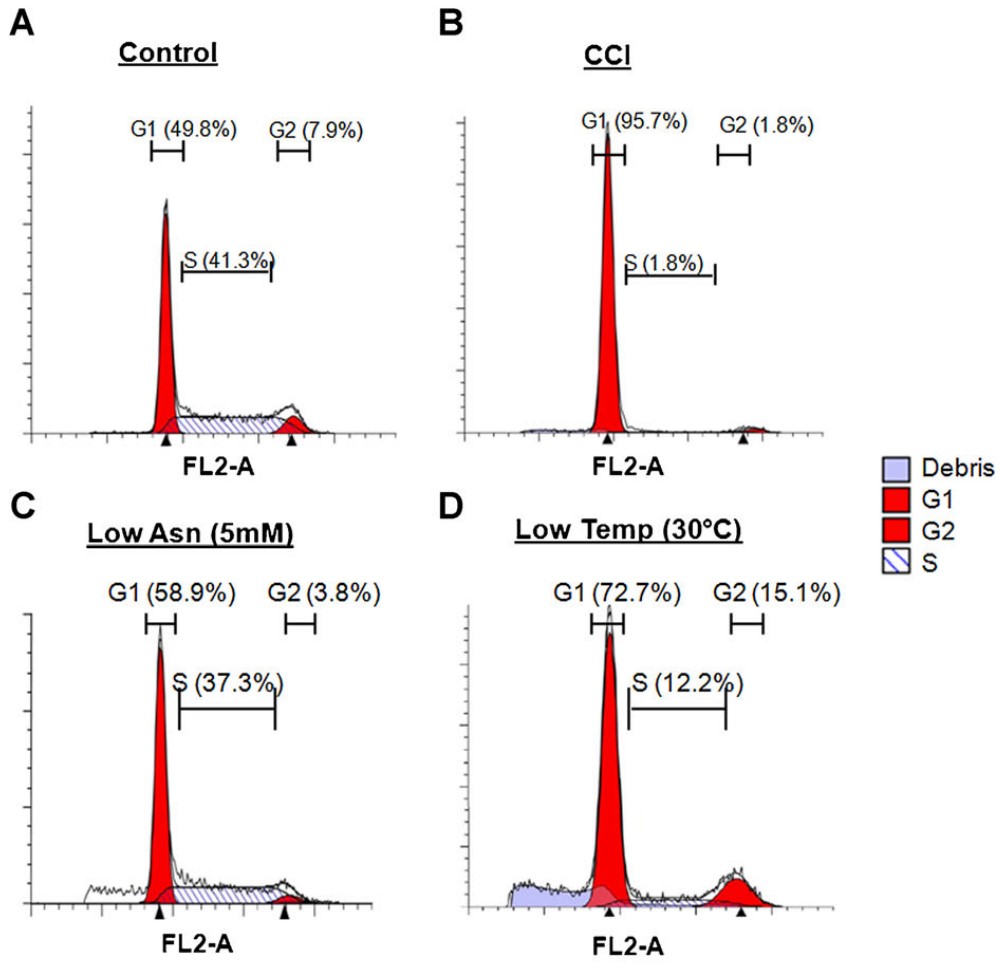
图 <!--[if supportFields]> SEQ 图 \*
ARABIC 6<!--[if supportFields]>对照组(A)、添加10mM CCI (B)、天冬酰胺限制(C) 、降温至30℃ (D) 条件下培养 24 小时后,PI 染色和流式细胞术分析分析细胞周期5
在不同CHO细胞的生产过程中,qP可以最高可提高到110 pg/cell/day。并且通过对蛋白产品质量的分析,抗体在纯度(HMW)和糖基化(N-glycan)方面无负面影响,并且有助于高甘露糖(HM)水平进一步的降低。这与其他降温等传统细胞周期控制策略形成鲜明对比。
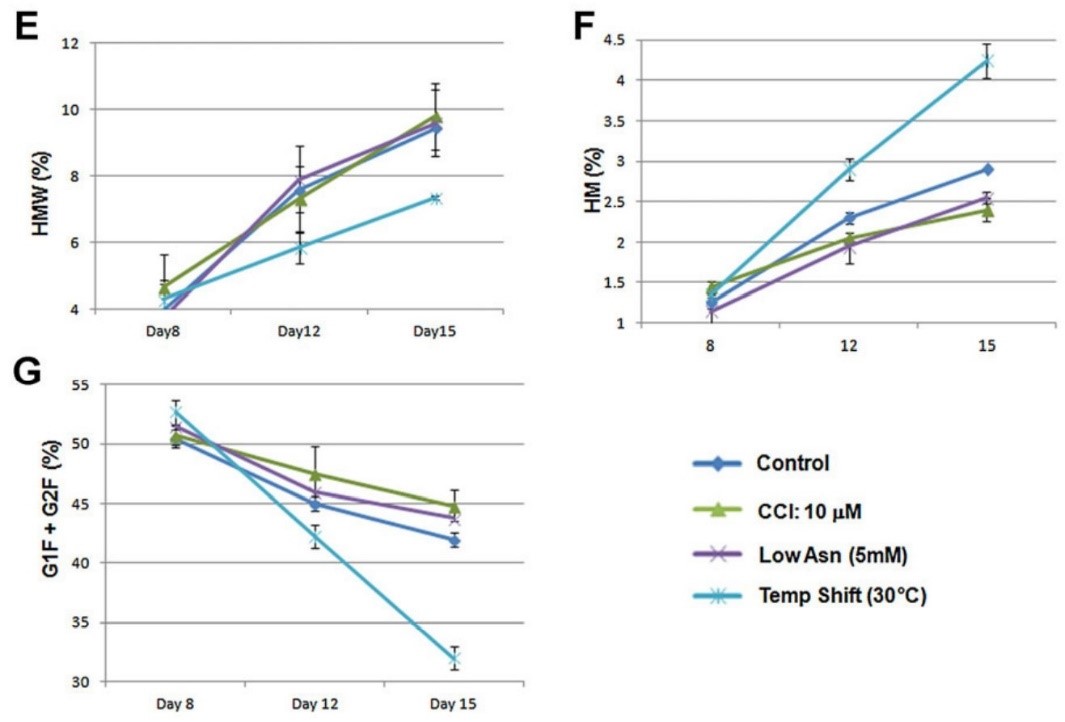
图 <!--[if supportFields]> SEQ 图 \*
ARABIC 7<!--[if supportFields]> 不同细胞周期控制策略下蛋白质量比较(HMW、高甘露糖、半乳糖比例)5
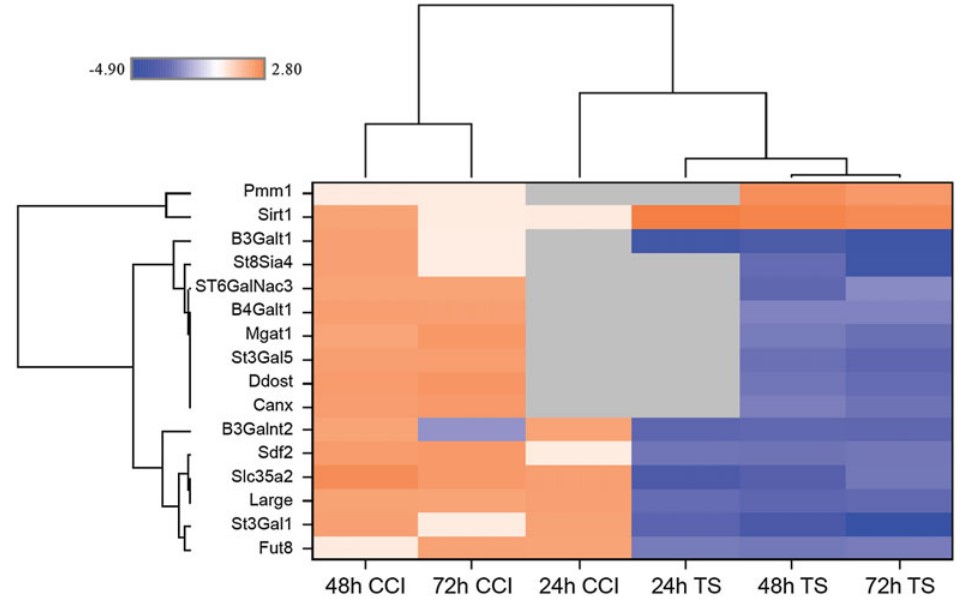
图 <!--[if supportFields]> SEQ 图 \* ARABIC 8<!--[if supportFields]> DNA微阵列分析CCI处理和降温处理后不同时间段酶和蛋白
Amgen团队通过DNA微阵列分析,进一步比较了CCI处理和降温条件关于糖基化修饰通路中参与的多种酶和参与糖蛋白质量控制的蛋白(如钙粘连蛋白)的mRNA水平,发现大部分相关蛋白在降温条件下显着降低,而在CCI处理的细胞中增加(<!--[if supportFields]> REF _Ref106281041 \h \* MERGEFORMAT 图 8<!--[if gte mso 9]>
同时,在参与细胞周期途径的基因表达图谱(The expression
profiles of genes involved in the cell-cycle pathway)中,发现内源性CKI(细胞周期蛋白依赖性激酶抑制物),如 p21和 p27(见<!--[if supportFields]> REF _Ref106271344 \h \* MERGEFORMAT 图 4<!--[if gte mso 9]>
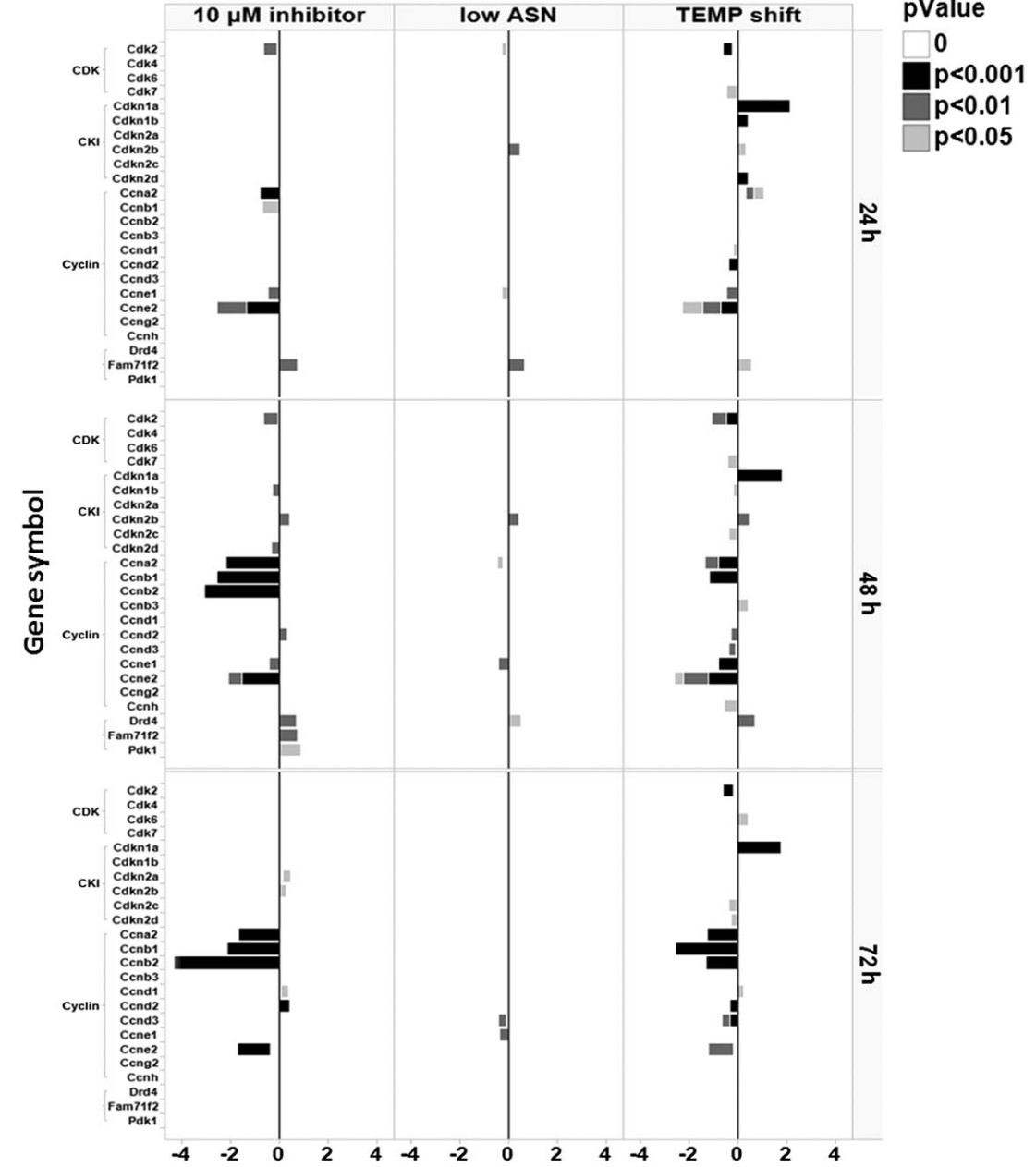
图 <!--[if supportFields]> SEQ 图
\* ARABIC 9<!--[if supportFields]> CCI处理、低Asn限制、降温限制后的CHO细胞周期相关基因变化情况5
在可以预见的未来,对于细胞周期和细胞培养工艺阶段的关系将会被进一步的挖掘。近年来,还有不同团队针对细胞周期的从细胞株改造以及预测模型搭建等方向加强了对细胞周期的控制。
例如,有团队通过敲除caspase-7在CHO细胞中的表达,使得细胞生长在在 G2/M 期经历了细胞周期停滞。这种细胞周期停滞导致细胞中荧光素酶的表达增加 1.7 倍6。
另有团队报道了通过建立荧光泛素化的细胞周期指示剂(FUCCI)系统来检测细胞周期变化,以及对各项细胞生长参数的监测,建立了细胞周期变化和各项细胞代谢参数的相关联数学模型,来收集细胞周期进程的合适条件和基于时间的数据集,以控制细胞群动态,避免意外波动引起的细胞周期分布振荡,从而提高生产过程稳定性和效率7。
参考文献:
<!--[if !supportLists]-->1.
<!--[endif]-->Flow cytometry in biotechnology.
2001 Aug;56(3-4):350-60. doi:
10.1007/s002530100673.
<!--[if !supportLists]-->2. <!--[endif]-->Increased productivity of recombinant
tissular plasminogen activator (t-PA) by butyrate and shift of temperature: a
cell cycle phases analysis.
2001
Jul;36(1-3):71-83. doi: 10.1023/A:1014088919546.
<!--[if !supportLists]-->3. <!--[endif]-->Characterization
of cell cycle and apoptosis in Chinese hamster ovary cell culture using flow
cytometry for bioprocess monitoring.
2022 Jan;38(1):e3211. doi:
10.1002/btpr.3211. Epub 2021 Oct 5
<!--[if !supportLists]-->4. <!--[endif]-->Decoupling Growth and Protein Production in
CHO Cells: A Targeted Approach.
2021 Jun 2;9:658325. doi:
10.3389/fbioe.2021.658325. eCollection 2021
<!--[if !supportLists]-->5. <!--[endif]-->Use of a small molecule cell cycle inhibitor
to control cell growth and improve specific productivity and product quality of
recombinant proteins in CHO cell cultures.
2015 Jan;112(1):141-55. doi:
10.1002/bit.25332. Epub 2014 Sep 2
<!--[if !supportLists]-->6. <!--[endif]-->Knockout of caspase-7
gene improves the expression of recombinant protein in CHO cell line through the cell cycle arrest in
G2/M phase.
2022 Jan
11;55(1):2. doi: 10.1186/s40659-021-00369-9
<!--[if !supportLists]-->7. <!--[endif]-->Process‐induced cell
cycle oscillations in CHO cultures: Online monitoring and model‐based
investigation.
2019
Nov;116(11):2931-2943. doi: 10.1002/bit.27124. Epub 2019 Aug 8.

 微信公众号
微信公众号