悬浮培养时细胞为什么会“聚集”
随着生物制品行业的快速发展,越来越多的基于哺乳动物细胞无血清全悬浮培养技术已经运用到各领域中。但是,悬浮生长的细胞系会在培养中形成大的、紧密结合的聚集体。细胞聚集阻碍了准确的细胞计数,监测和控制细胞环境;不利于氧气和营养物质输送进团块内部细胞,显著影响细胞的生长行为;同时,增加了转染、过滤或蛋白质纯化的难度。例如,HEK293细胞在悬浮培养中易产生聚集,导致在病毒包装的过程中,聚集中心的细胞不能被有效感染,从而大幅降低转染效率。
悬浮培养过程中细胞聚集的主要原因有: 凋亡细胞释放的DNA;过量的钙以及细胞粘附分子(Cell adhesion molecules,CAMs)。同时,细胞培养环境中的物理因素也可能导致细胞结团,如不适当的转速或大型反应器中较高的静水压力1。
什么是CAMs
CAMs是细胞表面蛋白质的一个子集,参与细胞与其他细胞或细胞外基质(ECM)的结合,它帮助细胞间以及与周围环境相互粘附。
CAMs有四个主要的家族,包括免疫球蛋白细胞粘附分子超家族(The immunoglobulin superfamily,IgCAMs)、钙粘蛋白(Cadherins)、整合素(Integrins)和选择素(Selectins)(图 1)2。其中,如上CAMs家族又分为钙依赖性(Ca2+-dependent)CAMs和非钙依赖性(Ca2+-independent)CAMs。IgCAMs和Integrins不依赖于Ca2+,Cadherins和Selectins依赖于Ca2+。此外,Integrins参与细胞-基质相互作用,其他CAM家族参与细胞-细胞相互作用。
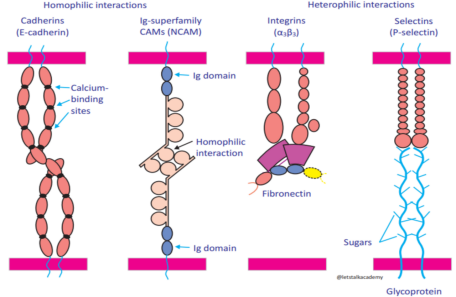
图 1 Structure of various types of CAMs
如何抗结团
物理方法(提高摇床速度以及在生物反应器中增加搅拌速率)可能有利于抑制细胞聚集,但也可能会引起细胞损伤。通常情况下,通过改变细胞培养组分来缓解或抑制细胞聚集成为更现实的做法。
1.抗结团剂
硫酸葡聚糖3,Pluronic F68等都是由于它们富含硫酸盐基团,通过改变细胞表面电荷,能够减缓细胞聚集并维持稳定的单细胞悬浮。

图 2 硫酸葡聚糖对CHO细胞形态影响。a:对照,b:1.2g/L硫酸葡聚糖。
苏拉明(Suramin)通过破坏细胞表面电荷分散细胞聚集物,从而改变Ca2+依赖的相互作用,或通过与其他细胞粘附分子结合阻止Ca2+依赖的细胞粘附4。
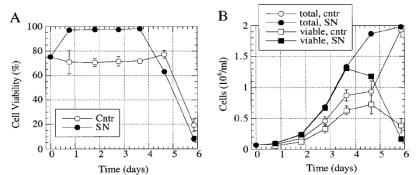
图 3 苏拉明对CHO K1:CycE的影响。(A) 细胞的活率。(B) 总细胞密度和活细胞密度。细胞分别用添加(SN) 0.05%苏拉明和不加(Cntr)培养。
此外,EDTA会螯合DNAse所必需的Mg2+离子,从而通过隔离二价阳离子来干扰细胞-细胞粘附分子。柠檬酸铁浓度以剂量依赖性的方式影响CHO细胞的粘附,低浓度增强粘附,高浓度增强单细胞形成5。
在大多数情况下,添加特殊的抗结团成分不影响细胞构建过程,但它们的存在使生物过程复杂化,可能需要额外的清除步骤或残留评估,并且不能完全消除细胞间的粘附和聚集形成。
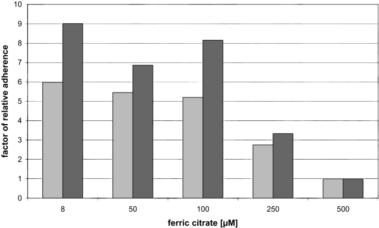
图 4 在添加不同浓度柠檬酸铁的无蛋白培养基中,CHO-K1和CHO-MPS的相对粘附因子。灰色:CHO-K1;黑色:CHO-MPS
2.优化培养基成分
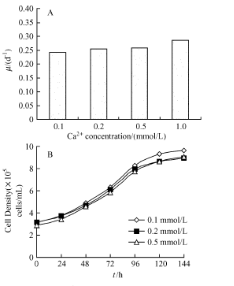
培养基中一些二价阳离子的存在会促进细胞聚集,Mn2+增加配体亲和力,Mg2+,Ca2+增加细胞粘附。Ca2+浓度在培养基中对细胞聚集有很大的影响,因为Ca2+依赖性桥粒和粘附型连接的存在,即使在含有低浓度Ca2+的培养基中,它们也积极参与细胞-细胞结合。因此,在易发生结团的如HEK293细胞的培养基开发设计过程中,可考虑将Ca等二价阳离子的浓度控制在较低的范围。
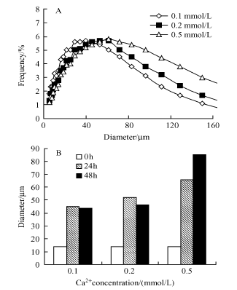
图5 Ca2 +浓度对HEK293细胞结团的影响
3.基因改造工程细胞株,降低粘附力
内皮细胞间细胞粘附分子1(ICAM-1)是CHO细胞系中促进细胞聚集形成的关键蛋白,它容易形成细胞聚集。在没有抗细胞聚集试剂的培养基中,敲除ICAM-1基因可显著减少细胞聚集的形成。这种特性可以简化转染、选择、自动克隆分离等过程。从图7可以观察到在没有抗细胞聚集剂的培养基中CHO-K1细胞聚集,而在敲除ICAM-1基因(ICAM KO)系中形成了最小的细胞聚集6。
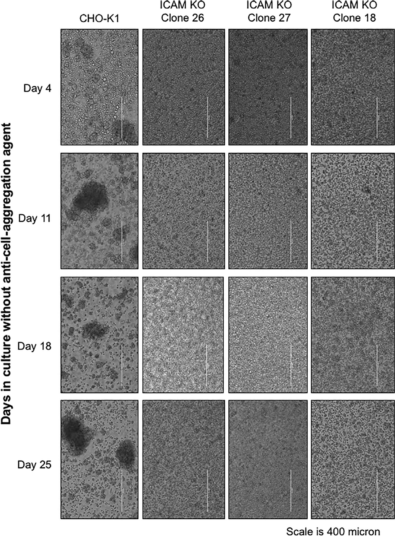
图7 三个ICAM KO的克隆(#18,#26,#27)和CHO-K1宿主,在无抗细胞聚集剂的培养基中培养25天
TM蛋白整合素β1(ITGB1)是各种整合素的中心相互作用伙伴α分子,因此能够参与许多细胞- ECM相互作用,ITGB1被确定为敲除实验的潜在靶点,以抵消CHO‐DG44 SEAP细胞系的聚集表型7。通过对该细胞系中ITGB1的瞬时小感染RNA(siRNA)实验,检测到ITGB1蛋白表达比对照组下调30%,mRNA水平下调50倍。
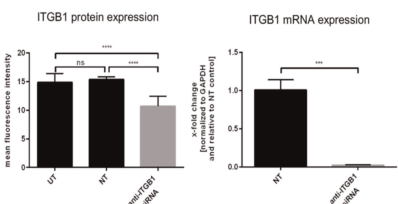
图8 转染100 nM抗ITGB1 siRNA 48 h后CHO‐DG44 SEAP细胞上ITGB1蛋白表达(左),ITGB1信使RNA的表达(右)
随后,在短暂转染抗ITGB1 siRNA 48小时后,与未处理的细胞和转染非靶向siRNA的细胞相比,转染细胞的聚集形成明显减少。这强调了表面蛋白在CHO生产细胞系代谢工程中的潜力。
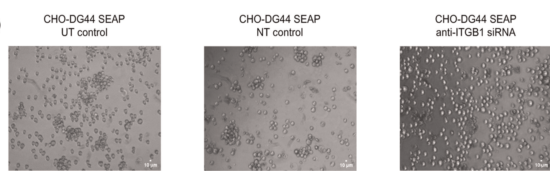
图9 转染100 nM抗ITGB1 siRNA 48小时后CHO‐DG44 SEAP细胞的显微镜图像
最近,Shurer等人在悬浮293F细胞上进行了演示,提出了一种基因编码技术,指导合成细胞表面的抗粘附和保护涂层。通过工程粘蛋白结构域融合合成跨膜锚,从基因上编码新的细胞表面涂层,以强烈减缓细胞聚集,并保护悬浮细胞免受流体剪切应力的影响。该涂层显示出比商业上可用的抗聚集剂更好的性能8。
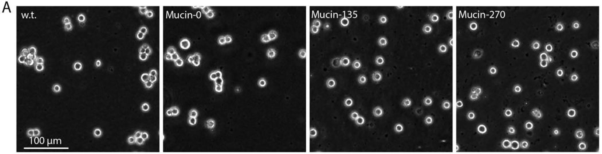
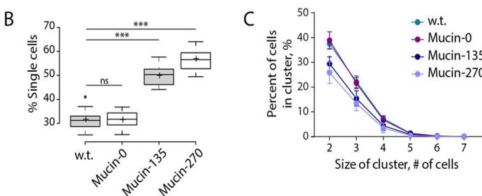
图10 Mucin-135和mucin-270的基因编码生物聚合物涂层在悬浮细胞培养中减少了细胞聚集。A. w.t.(原细胞株)和生物聚合物细胞系(mucin-0, mucin-150, mucin-270)的相位对比图像;B. 从相位对比图像(A)中量化不同簇大小的细胞比例;C. 从相位对比图像(A)中量化不同大小的细胞簇的百分率
参考文献
1. Shang M., Taehong Kwon, Jean‑Francois P. Hamel, Chwee Teck Lim, Bee Luan Khoo & Jongyoon Han. Investigating the influence of physiologically relevant hydrostatic pressure on CHO cell batch culture. 2021, 11:162. doi:10.1038/s41598-020-80576-8.
2. https://letstalkacademy.com/cell-adhesion/
3. Jing Y., Zhang C., Fu T., Jiang C., Ma K., Zhang D., Hou S., Dai J., Wang H., Zhang X., Kou G., Guo Y. Combination of dextran sulfate and recombinant trypsin on aggregation of Chinese hamster ovary cells. Cytotechnology. 2016, 68: 241–248.
<!--[if !supportLists]-->4. <!--[endif]-->Zanghi J.A., Renner W.A., Bailey J.E. & Fussenegger M. The growth factor inhibitor suramin reduces apoptosis and cell aggregation in protein-free CHO cell batch cultures. Biotechnol. Prog. 2000, 16: 319-325.
<!--[if !supportLists]-->5. <!--[endif]-->Karlheinz Landauer, Susanne Wiederkum, Markus Durrschmid, Helga Klug, Gordana Simic, Gerald Bluml, & Otto Doblhoff-Dier. Influence of Carboxymethyl Dextran and Ferric Citrate on the Adhesion of CHO Cells on Microcarriers. Biotechnol. Prog. 2003, 19: 21-29.
<!--[if !supportLists]-->6. <!--[endif]-->Salina Louie, Amy Heidersbach, Noelia Blanco, Benjamin Haley, Christopher M. Rose, Peter S. Liu, Mandy Yim, Danming Tang, Cynthia Lam, Wendy N. Sandoval, David Shaw, Brad Snedecor. Endothelial intercellular cell adhesion molecule 1 contributes to cell aggregate formation in CHO cells cultured in serum-free media. Biotechnology Progress 2020, 36: e29251. DOI: 10.1002/btpr.2951.
<!--[if !supportLists]-->7. <!--[endif]-->Florian Klingler, Sven Mathias, Helga Schneider, Theresa Buck, Nadja Raab, Nikolas Zeh, Yu‐Wei Shieh, Jens Pfannstiel, Kerstin Otte. Unveiling the CHO surfaceome: Identification of cell surface proteins reveals cell aggregation‐relevant mechanisms. Biotechnol Bioeng 2021, 1–14. DOI: 10.1002/bit.27811.
<!--[if !supportLists]-->8. <!--[endif]-->Carolyn R. Shurer, Shelby E. Head, Marc C. Goudge, & Matthew J. Paszek. Mucin-Coating Technologies for Protection and Reduced Aggregation of Cellular Production Systems. Biotechnol Bioeng 2019, 116(5): 994–1005. DOI:10.1002/bit.26916.

 微信公众号
微信公众号